PROBLEM 7
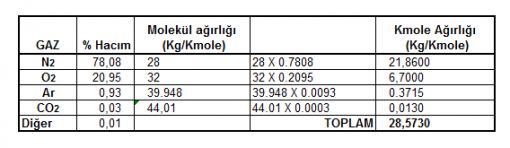
GAZ KARIŞIMININ AĞIRLIĞININ BULUNMASI Hacımsal yüzdeleri belli olan bir gaz karışımının ağırlığını bulmak için uygulanacak hesap yöntemini aşağıdaki örnek üzerinden anlatabiliriz. ÖRNEK: Hem havanın özelliklerinden bahsetmiş olmak hem de gaz karışımının nasıl hesaplanabileceğini göstermek için örnek olarak Normal atmosfer koşullarındaki 5 M3 havanın ağırlığını hesaplayalım. Gaz karışımlarının ağırlığını bulmak için karışımdaki gazların her birinin hacımsal yüzdelerinin bilinmesi gerekir. Bizim örneğimiz hava olduğu için bilindiği üzere havadaki gazların yüzdeleri aşağıdaki gibidir. HAVADA BULUNAN GAZLAR Nitrojen ….........…..:78.08 % (Detaylı yüzdeleri verilmeyen ve havadaki hacımsal oranları toplamı onbinde bir olan diğer gazlar Hidrojen, Neon, Helyum, Metan, Kripton, Nitrik oksit, Xenon ve Ozon gazlarıdır) Bu gazların ağırlığını hesaplamak için önce gazların molekül
ağırlıkları hesaplanarak aşağıdaki gibi bir tablo üretilir. (Molekül ağılıklarını hesaplamak için gerekli ATOM AĞIRLIKLARI TABLOSU ) |  |
Yukarıdaki tablodan 1 Kmole havanın 28.57 Kg ağırlığında olduğunu bulduk.
Tüm gazlar için geçerli olarak 1 Kmole gazın hacmı Normal atmosfer koşullarında 22.414 NM3 tür (Molar volume).
22.414 NM3 Gaz = 1 Kmole Gaz
1 NM3 havanın ağırlığı = 28.57 / 22.414 = 1.2 Kg/ NM3
5 NM3 havanın ağırlığı = 1.2*5 = 6 Kg olarak bulunur.
HAVA BASINCI
Atmosfer basıncı olarak bildiğimiz hava basıncın sebebi
yukarıda hesaplanan havanın ağırlığıdır.
Havadaki gazların 75% i ilk tabaka
olan troposferde bulunur ve yükseklik arttıkça gazların yoğunluğu azalır.
Atmosfer kalınlığındaki ortalama gaz yoğunluğunu deniz seviyesindeki gaz
yoğunluğuna eşdeğer kılacak hava yüksekliği 8610 metreye denktir. Bu nedenle
deniz seviyesinde basıncı oluşturan havanın yüksekliği 8,610 metre kabul
edilir.
Böylece deniz kenarında 1 metrekare alan üzerindeki havanın ağırlığını hesaplayacak olursak.
W=V*ρ
A=1 m2
V=8610 m3
ρ= 1.2 Kg/m3
W=8,610*1.2 =10,332 Kg
P=W/A
P=10,332 Kg/m2
= 1 Atü
Deniz kenarından yüksek yerlere çıkıldıkça havanın ağırlığı ve dolayısı ile basıncı azalır. Everest tepesinde bu basınç yaklaşık 60% azalarak 0.4 Atü ye kadar düşer. Bu nedenle dağcılar tırmanma sırasında vurgun yememek için özel önlemler almak zorundadırlar
AVAGADRO SAYISI
Konu ile ilinitisi bakımından önemli bir sabiti vermekte yarar var.
Tüm gazlar için geçerli olmak üzere aynı basınç ve sıcaklıkta bulunan 1 mole gaz içerisinde 6.022 X 1023 adet molekül bulunur. Bu sayıya AVAGADRO sayısı denir